
10月2日,2023年的諾獎生理學或醫藥學獎,以「冷門的方式」,頒給了一項大熱門——一個對mRNA新冠疫苗研制有突破性貢獻的科學發現。
更多時候,諾獎的頒發因其滯後性有所爭議。諾獎是樂於等待的,一直等到確認一項科學成果經受住了時間的檢驗。
但這一次的諾獎,少有地反應迅速:由德國生物技術公司BioNTech的卡塔琳·卡里科(Katalin Karikó)和美國賓夕法尼亞大學教授德魯·魏斯曼(Drew Weissman)捧得,「以表彰他們在核苷鹼基修飾方面的發現,使針對新冠的mRNA疫苗得以開發」。
從另一個角度看,這次的獲獎者也是「冷門」人選:卡里科,是第13位獲得諾獎的女科學家。
這位匈牙利籍女性對mRNA分子的熱情和超出常人的執著,很長時間在學術圈被輕視。回望她30多年遠渡重洋後在美國的生活,她只有一個目標,推動合成mRNA在人類細胞的應用。因為這個不主流、不被看好的分子研究,她長期拿不到科研基金,被各個科研組像踢皮球一樣踢走。
但卡里科樂意沉浸於自己的mRNA世界。她在10年前被工作了20多年的賓大解雇,又轉身去往德國,自己做實驗,重新培養質粒、播種細胞。
直到新冠大流行,卡里科的熱情與毅力終於有了直觀的證明。兩位科學家的研究告訴世界,小小的mRNA,可以迅速指導人類細胞,製造自己的保護傘。

女兒拿了兩次奧運冠軍
支撐這位女科學家前進的,是她的丈夫,和遠比卡里科出名的女兒蘇珊·弗朗西亞——2008年北京奧運會、2012年倫敦奧運會「女子八人單槳有舵手」項目金牌得主。
弗朗西亞在一次採訪中曾經回憶:「匈牙利有一首名為《鑽石和黃金》的歌曲,每當我的職業生涯遭遇困難和挫折時,母親就把它唱給我聽。她教導我,努力工作是生活的一部分,如果你接受它,就會有回報。」
這種堅韌不拔的精神幾乎就是弗朗西亞的家庭生活的縮影——不畏艱險,努力不斷進取,即使各種挑戰都被拋到面前。

在收到諾獎的通知電話時,卡里科說:「作為女人和媽媽,我想對女性科學家說,你不必在家庭和工作中做出取捨,不必過度照料孩子。你做了什麼才是重要的,她會把你視為榜樣。」
聊起比賽和自己的母親,弗朗西亞曾這麼形容:「賽艇運動中,運動員往往都是背對著終點,這意味著你看不到終點和你的距離。我的母親同樣也是如此。 她無法知道哪裡才是真正的終點,但在這個過程中你需要相信,每一次付出,都會讓你距離終點越來越近。」
天才執著
天才少女卡里科有一個夢想,卻很少被人珍視。她在匈牙利人口1萬人的小鎮出生,小時候,她給屠夫父親打下手,為自家的肉店做香腸。
所有人都以為,她會繼承父業,成為出色的生意人。
但她在16歲時卻寫下這樣的夢想:做一名科學家。屠夫的女兒在陰冷的歐洲中部,第一次有了像鳥飛過大山那樣的決心。
命運的轉折在30歲來臨。已經在匈牙利一間大學做研究員的卡里科,研究所的資金突然斷裂,她決定帶丈夫與女兒遷往美國,繼續深造。
她的夢想變得愈加具體。一個關於mRNA的大膽猜想正待證明。
遷徙異國時,卡里科前途未卜。為這段前程投下陰影的還有,當時匈牙利當局採取的外匯管控政策,只允許出境者帶最高額度的100美元。卡里科將所有的資產——900美元縫進了女兒的小熊玩偶裡,然後帶著小熊飛出了國門。
1985年,抵達美國時,她沒有信用卡,沒帶手機,也沒有美國的親朋好友,一心只想著研究。她後來說:「在我們匈牙利,如果缺少某個化學品,我們就想辦法查如何製作它,而不是說,『那個東西我們訂不到』。」
此時的mRNA研究,在國際上有了許多突破性的成果。1961年,信使 RNA (mRNA) 被法國科學家首次發現。不久,研究人員弄清楚了遺傳信息的規律:人類細胞以雙鏈的脫氧核糖核酸DNA為模板,通過轉錄產生單鏈的核糖核酸RNA,再以信使 RNA (mRNA) 為模板,表達蛋白質。

這種信使專門監督特定蛋白質的組裝。也就是說,知道了mRNA序列,就可以確定蛋白質的信息。
有了這個前提,科學界開始有了更大膽的設想:如果反過來,人類可以合成mRNA,是不是就可以誘導體內產生特定的蛋白質?
卡里科深信小小分子的大作用,尤其是用在疫苗上。
畢竟,蛋白質與人體免疫系統息息相關。病毒的蛋白質可以激活人體的免疫反應。
設想一下,先在人體內注射病毒的mRNA編碼,誘導體內產生了病毒的蛋白質。免疫系統接著發生作用,提前產生抗體。如此一來,等真正的病毒來臨時,人體一早就做好了準備。
這在當時是免疫學從未設想過的路。在過往300年的疫苗史裡,從來都只是體外注射少量病毒於體內,引發免疫系統殺死、減滅病毒。或者將改變化學結構的病毒注射體內,從而訓練免疫系統對病毒的抵抗力。沒有人想過,讓人體自身製造出病毒來。
這個看似天衣無縫的邏輯,在當時幾乎無人理解。

卡里科在美國賓大的第一任合作者,心臟病學家埃利奧特·巴納森記得,他與卡里科嘗試將mRNA植入細胞時,「大多數人都嘲笑我們」。這個研究有了些許進展,但以巴納森放棄教職,跳槽進公司告終。
卡里科漂流進了第二個實驗室。她仍然堅持用mRNA植入細胞,想引發載體的免疫反應。這次還是失敗。合作者又跳槽去了別的生物公司,連繫主任也離任了。
這些失敗一次次印證了普通研究者的判斷:mRNA沒法保證安全性;且很難刺激細胞產生大量的蛋白質,有效性也堪憂。
很長的時間裡,偉大只停留在假想,在她的大腦中。
「別費心了」
命運的改變總在那些不經意的瞬間。
在賓大,苦於零經費的卡里科,放不下mRNA的美好在未來帶給人的血脈賁張。核酸療法給人的想像像黑洞一樣吸引著她,那種天然的便利性——只需要掌握一段病毒序列就能刺激免疫系統提前作用的能力,誘惑她,讓她無法不投身其中。
1997年,因過於沉迷不被看好的mRNA,卡里科被降了職。而這時,在等待打印期刊論文的復印機前,她遇到了醫學院新教員魏斯曼。
「我是一名 RNA 科學家,我可以用 mRNA 製造任何東西。」她告訴對方。
魏斯曼說,自己致力於研制出愛滋病病毒疫苗。也還得是卡里科,回他說:「是的,是的,我能(用mRNA)做出來。」
兩人一拍即合。卡里科以低級別研究員的身份加入了魏斯曼團隊。

但這依然是充滿失敗的年月。人工製造 mRNA 分子,她已經實現了。她的設想在指示培養皿中也很理想,細胞果真能製造她想要的蛋白質。可是,一將mRNA 注入活體小鼠中,一切又失序了。
「我們只看到老鼠生病了。它們皮毛蓬亂,蜷縮起來,停止進食,停止奔跑。」魏斯曼回憶。
魏斯曼和卡里科研究的方向,變成了如何讓mRNA進入載體時逃過免疫系統的監視,不再引發強烈免疫反應。
與mRNA的冒險,伴隨著自身的執念,讓卡里科整天魂不守捨。她領著很低的工資,卻整天泡在實驗室里。丈夫還為她算過,如果以時薪計,「卡里科的時薪只有1美元」。
直到一次的對照組試驗中,兩人終於發現,自己的mRNA注入引發免疫系統的過度反應時,對照組裡注入載體內另一種形式的RNA,tRNA,沒出現炎症反應。
那個夢寐以求的答案得以浮現。tRNA中一種叫做假尿苷的分子(pseudouridine),是它起了作用,幫注入載體的核酸躲避免疫反應。
他們終於明白,mRNA是一種由4種核苷酸按照不同排列順序形成的單鏈結構。4種核苷酸的差別在於核苷鹼基不同。其中,一種鹼基叫尿嘧啶,成為了問題的關鍵。
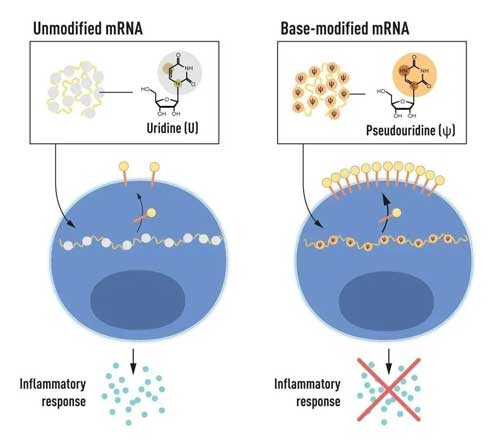
它與核糖有兩種連接方式,正常情況下形成尿苷,但特殊情況下還能形成假尿苷。只要用假尿苷代替尿苷,形成修飾mRNA,便能有效躲避免疫系統的監視。
不僅如此,這個假尿苷還能使mRNA的功能更強大,指導每個細胞合成10倍的蛋白質。
也就是說,將這一技術注入載體,保障了安全有效。
兩人一直苦求的研究,在無盡的黑暗中找到瞭解法。
2005年,魏斯曼和卡里科將這個自認為「有潛力改變醫學」的新技術成果,發表在《免疫》雜誌。
自信滿滿的魏斯曼告訴後輩,發表後,「我們的電話肯定會響個不停」。
結果,「什麼也沒發生,」卡里科回憶,「我們一個電話也沒接到。」
原以為的醫學界命運轉折點,本該蜂擁而至的關注,都是想像而已。討論起疫苗,人們提到的,還是三百年來拯救人類於水火的滅活疫苗與減毒疫苗。
「我倆這時都在申請基金。」魏斯曼回憶。結果,「人們對 mRNA 不感興趣。審查基金的人說,『mRNA 不會是一種好的治療方法,所以別費心了。』」
一戰成名
故事還未結束。
卡里科終於迎來拯救世界的時候。
如果不是新冠大流行,兩位修飾mRNA技術的奠基者,也還是無名小卒而已。
關於mRNA技術疫苗的研究,只有極少數公司注意到。可以預見,這是一個投入巨大但充斥未知的領域。
mRNA 療法的追逐者,瞄准的都是人類疾病的「天花板」——戰勝了無數家庭的癌症。
2010年,用於治療前列腺癌的mRNA疫苗Provenge臨床試驗首次啓動。這類癌症疫苗與宮頸癌(HPV)疫苗不同,後者屬於預防性疫苗,而mRNA癌症疫苗為治療性疫苗。
研究者想要實現的是,疫苗一針打下去,讓患者的免疫系統學會分辨偽裝的腫瘤細胞,讓癌症細胞灰飛煙滅。
想法很美好,但技術突破之路,還得從一路的泥濘中一次次將腳拔出來。Provenge疫苗沒有帶來人們所盼望的成效,臨床試驗結果顯示,它僅將前列腺癌患者的總體生存期延長了4.1個月。而且,這款疫苗定價9.3萬美元,遠超普通人負擔得起的價格。
研發癌症疫苗Provenge的母公司,以破產告終。
至於魏斯曼和卡里科兩人,於2006年成立公司RNARx。因為資金耗盡等因素,RNARx在2010年倒閉。2013年,沒做出重要學術成果的卡里科,被賓大退了教職。

他們的mRNA設想,此時愈加岌岌可危。很多地方還無法突破。比如,癌症疫苗一直以來有個瓶頸,癌細胞在每個人的身上反應都不同,特異性很強,且癌變速度快。
如何在眾多癌細胞中,選取出現頻率最高的腫瘤抗原,讓mRNA疫苗具有普適性。在漫長的臨床實驗中,這很難辦。
同時,mRNA的單鏈結構也在真正的試驗中出現問題。mRNA很不穩定,不僅需要超低溫下保存,而且很容易被細胞外RNA酶降解。
21世紀的第二個10年,科學家決定搭建讓mRNA抵達細胞的途徑。
最終,在魏斯曼、卡里科以及英國科學家皮特·庫利斯等人的共同努力下,2015年,脂質納米粒(LNP)被發明。這種微小的納米氣泡,就像湯圓皮一樣,將mRNA緊緊包裹,保護它不被分解,最終安全送至細胞。
也是在這一年,第一個mRNA流感疫苗通過脂質納米粒進行測試。
儘管此時,這還是一個公眾層面無人知曉的技術。
直到2020年的新冠大流行,此前所有的努力與沈澱都在這次流行病中得以展現。運用修飾mRNA技術,新冠mRNA疫苗通過快速的病毒基因測序,而不是像傳統做法在蛋清等培育病毒,直接讓冠狀病毒的mRNA進入人體。

mRNA疫苗,在面對流行疾病的簡單、快速、安全,終於被世人知曉。
當然,其中的疑問仍存:同樣是mRNA技術,為什麼腫瘤疫苗數年研究無果,偏偏在新冠疫苗上一戰成名?
美國加州大學聖迭戈分校醫學院前教授楊海濤曾對南風窗解釋,這與兩種疫苗的臨床試驗規模有關。
一般而言,癌症治療的試驗規模只有幾十人至幾百人,樣本數不夠大,對安全和實用效果的評估也就不夠科學和精准。
「在全世界找3萬個相同病情、相同年齡、相同生活和飲食習慣的癌症病人,難度和開銷多大?但新冠疫苗目的是預防,臨床試驗對象的選拔條件更寬鬆,三期臨床試驗能輕易擴展至3萬人。」
楊海濤認為,新冠疫苗的應用,加速驗證了mRNA技術路徑的安全性和實用性,為往後腫瘤疫苗的研發掃清障礙,二者「互相成就」。
新冠疫苗讓mRNA領域信心大增。最早擁有相關技術的莫德納今年放話稱,正研制個體化的腫瘤疫苗,預計5年內落地。「預計在本世紀末,用mRNA疫苗消滅腫瘤。」
如今,很顯然的是,對終其一生研究mRNA技術的卡里科和魏斯曼,一旁的電話會反復響起了。■




Be the first to comment